O panorama regulatório da terapia CAR-T no Brasil

A terapia com células CAR-T tem despertado grande interesse no cenário médico brasileiro, não apenas pelo seu potencial terapêutico, mas também pelos desafios regulatórios que acompanham sua implementação. Como se trata de uma tecnologia avançada e de alto custo, sua entrada no país exige avaliação criteriosa de órgãos reguladores, com foco em segurança, eficácia e viabilidade de aplicação.
A Agência Nacional de Vigilância Sanitária (Anvisa) desempenha papel central nesse processo, estabelecendo normas para pesquisas e ensaios clínicos. Além disso, iniciativas públicas e privadas buscam alinhar o desenvolvimento científico às diretrizes legais. Nesse contexto, compreender o panorama regulatório é fundamental para antecipar os caminhos da CAR-T no Brasil.
O debate envolve desde a produção local até a incorporação ao sistema de saúde. Isso evidencia como regulação e inovação caminham lado a lado.
O que são terapias CAR-T e seu papel no tratamento do câncer no Brasil
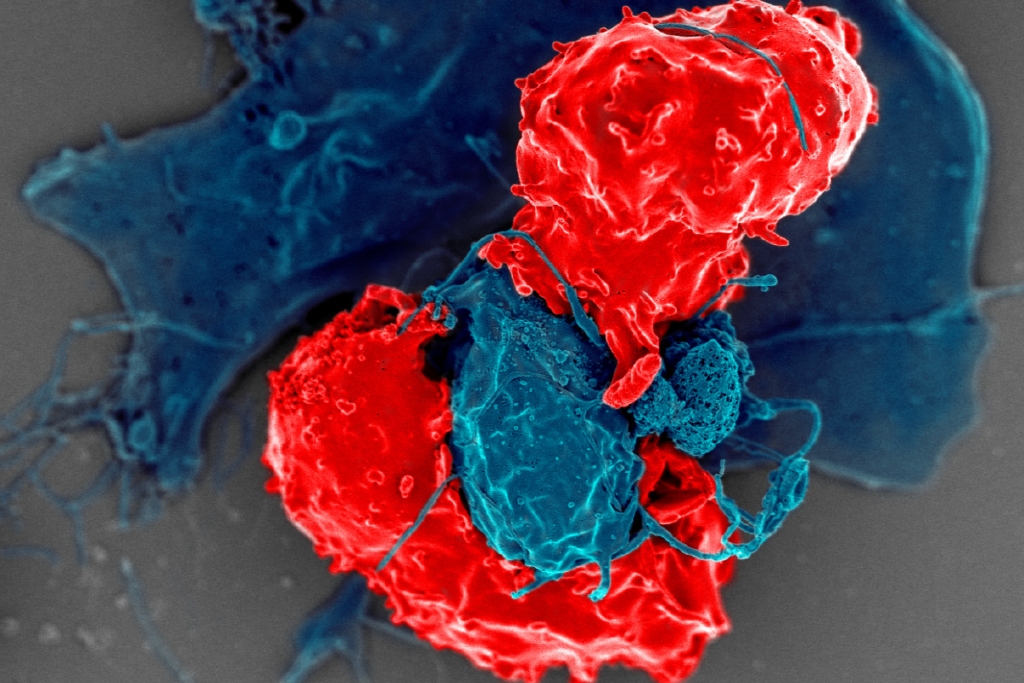
A terapia CAR-T é uma forma inovadora de imunoterapia celular que utiliza os próprios linfócitos T do paciente, modificados em laboratório para reconhecer e atacar células tumorais de forma direcionada. Nesse processo, as células T recebem um receptor quimérico (CAR), que atua como uma espécie de “antena” capaz de identificar antígenos específicos presentes em células cancerígenas.
Após essa modificação genética, as células são expandidas e reinfundidas no organismo, passando a combater o câncer de maneira mais eficaz.
No Brasil, a CAR-T tem ganhado espaço principalmente no tratamento de cânceres hematológicos, como leucemias e linfomas refratários a terapias convencionais. Ainda em fase inicial de implementação, a tecnologia enfrenta desafios relacionados ao custo, infraestrutura e regulamentação, mas já conta com ensaios clínicos conduzidos por instituições de destaque, como o Instituto Butantan e o Hemocentro de Ribeirão Preto.
Esses avanços colocam o país em uma posição estratégica para ampliar o acesso à medicina personalizada e consolidar sua atuação no campo das terapias avançadas.
Novas regulamentações da Anvisa para 2025: segurança, eficácia e acesso
A Agência Nacional de Vigilância Sanitária (Anvisa) já possui normas voltadas a produtos de terapias avançadas, como a RDC nº 338/2020, que estabelece requisitos para pesquisas clínicas, e a RDC nº 506/2021, que regulamenta a fabricação e o controle de qualidade de medicamentos de terapia celular.
Para 2025, a expectativa é que novas atualizações reforcem ainda mais os critérios de segurança, eficácia e rastreabilidade da terapia CAR-T, alinhando o Brasil às melhores práticas internacionais.
Essas regulamentações devem incluir diretrizes específicas para laboratórios credenciados em boas práticas de fabricação, além de protocolos de monitoramento prolongado dos pacientes tratados. Outro foco será a ampliação do acesso, garantindo que, a partir de um arcabouço regulatório claro e transparente, centros de pesquisa e a indústria possam avançar em parcerias para produção nacional.
Dessa forma, a Anvisa se posiciona como peça-chave no equilíbrio entre inovação, proteção ao paciente e viabilidade econômica para o futuro da CAR-T no país.
Impactos e perspectivas do Brasil no cenário global de terapias avançadas
A consolidação de regulamentações específicas para a CAR-T pode colocar o Brasil em uma posição estratégica no cenário internacional. Ao estruturar um marco regulatório robusto, o país demonstra capacidade de alinhar segurança e inovação, o que fortalece sua credibilidade científica e atrai parcerias globais.
Para os pacientes, o impacto direto está na possibilidade de acesso a tratamentos que antes estavam restritos a centros no exterior, reduzindo desigualdades no cuidado oncológico.
No campo científico, os avanços em terapias avançadas, liderados por instituições como o Instituto Butantan e o Hemocentro de Ribeirão Preto, ampliam a autonomia nacional em pesquisa e desenvolvimento. Além disso, a produção local de terapias celulares contribui para reduzir custos e facilitar a incorporação no Sistema Único de Saúde (SUS).
Ao mesmo tempo, o Brasil passa a integrar um movimento global de inovação em medicina personalizada, reforçando sua posição como referência emergente em imunoterapia celular.
Um novo horizonte para a CAR-T no Brasil
O progresso das terapias com células CAR-T depende tanto do avanço científico quanto da capacidade de tornar esse tratamento viável e disponível para quem precisa.
Nesse contexto, a Verdie atua como facilitadora, conectando especialistas, centros de pesquisa e instituições de saúde em torno de um objetivo comum: ampliar o acesso à medicina de ponta.
Ao investir em inovação, produção em escala e protocolos seguros, a empresa contribui para aproximar o país das tendências internacionais em imunoterapia. Quer descobrir como participar dessa transformação e apoiar a chegada de novas possibilidades ao cuidado oncológico no Brasil? Fale com a Verdie e faça parte desse futuro.
Publicações relacionadas
Procurando algo?